N - n
<>N<>:
rae;
1. f. Decimocuarta letra del abecedario español, que representa el fonema
consonántico nasal alveolar, aunque cuando es implosiva suele adoptar la zona
de articulación de la consonante siguiente. 2. f. Sonido que representa la letra
n. 3. f. Mat. Número indeterminado, como en 5n.
<>·Nadar<>:
rae; Del latín ·natâre·. 1. intr. Dicho de una persona o de un animal: Trasladarse en el agua ayudándose de los movimientos necesarios, y sin tocar el suelo ni otro apoyo. 2. intr. Dicho de una cosa: Flotar en un líquido cualquiera. 3. intr. Abundar en algo.
·Natural: rae; 1. Perteneciente o reltativo a la naturaleza o conforme a la cualidad o propiedad de las cosas.
·Naturaleza:
rae; 1. Principio generador del desarrollo armónico y la plenitud de cada ser, en
cuanto tal ser, siguiendo su propia e independiente evolución. 2. Conjunto de todo
lo que existe y que está determinado y armonizado en sus propias leyes.
·Neurona:
rae; Del alemán ·Neuron·, y este del griego ?e???? neûron 'nervio'.. 1. f.
Anatomía. Célula nerviosa, que generalmente consta de un cuerpo de forma variable
y provisto de diversas prolongaciones, una de las cuales, de aspecto filiforme y
más larga que las demás, es el axón o neurita.
·Neutrón:
Rae; Del inglés ·neutron·, de ·neutral· "neutral" y ·-on· "-ón2". 1. m. Fís.
Partícula elemental sin carga eléctrica, que forma parte del núcleo del átomo.
/// <>Neutrón<>:
energia-nuclear.net - (31/01/2017- Martes.20:54);
Un neutrón
es una partícula subatómica contenida en el
núcleo atómico. No tiene carga eléctrica neta, a diferencia del protón que tiene
carga eléctrica positiva. El número de neutrones en el núcleo atómico de un
elemento determina el isótopo al que forma parte.
Descubrimiento del neutrón.
El primer indicio de la existencia del neutrón se produjo en 1930, cuando
Walther Bothe y Becker, encontro que cuando la radiación alfa cayó sobre
elementos como el litio y boro se emitió una nueva forma de radiación.
Inicialmente, esta radiación se creía que era un tipo de radiación gamma,
pero era más penetrante que cualquier radiación gamma conocida. El trabajo
realizado por Irene Joliot-Curie y Joliot Frederic en 1932, aunque no refuta la
hipótesis de la radiación gamma, no lo soporta todo bien.
En 1932, James Chadwick demostró que estos resultados no podían ser
explicados por los rayos gamma y propuso una explicación alternativa de partículas
sin carga de aproximadamente el mismo tamaño que un protón. Chadwick fue capaz de
verificar experimentalmente esta conjetura y así demostrar la existencia del
neutrón.
Detalles de neutrones.
El neutrón está formado por tres quarks, un quark arriba y dos quars abajo.
La masa del neutrón es ligeramente mayor que la del protón.
El neutrón no existe fuera largo del núcleo atómico, sólo unos meros 885
segundos (15 minutos) en promedio.
Masa: 1.67492729 x 10-27 Kg.
Carga: 0
Spin: 1/2
Debido a que el neutron tiene un espin 1/2, es un fermión.
·Neutrón lento: Rae; . 1. f. Fís. Neutrón con velocidad del mismo orden que la agitación molecular a temperatura normal.
·Neutrón rápido: Rae; . 1. f. Fís. Neutrón de velocidad comparable con la de la luz.
·Nieve:
rae; Del latín ·nix·, ·nivis·. 1. f. Agua helada que se desprende de las nubes
en cristales sumamente pequeños, los cuales, agrupándose al caer, llegan al suelo
en copos blancos.
·Niquel:
rae; Del alemán ·nickel·. 1. m. Elemento químico metálico, de (número atómico 28),
del color y brillo de la plata, duro, tenaz y resistente a la corrosión, escaso en
la corteza terrestre, donde se encuentra nativo en meteoritos y, combinado con azufre
y arsénico, en diversos minerales, que constituye junto con el hierro el núcleo de la
Tierra, y que se usa en el recubrimiento de superficies y en la fabricación de baterías
eléctricas, monedas y aceros inoxidables. (Símbolo Ni).
·Nitrato
Rae; De ·nitro· y ·-ato 2.
1. m. Quím. Sal formada por la combinación del ácido nítrico con una base.
/// ·Nitrato:
WikipediA - (21/11/2016-lunes); Los nitratos son sales o ésteres del ácido
nítrico HNO3
·Nitrato de amonio:
Rae;
1. m. Quím. Sólido incoloro que forma cristales, solubles en agua y en alcohol,
usado como oxidante y como fundente de metales, y también en la producción de mezclas
frigoríficas, fertilizantes y explosivos.
·Nitrato de Chile:
Rae;
1. m. Abono natural formado por una mezcla de nitratos y extraído del caliche, que
se encuentra en yacimientos situados en la zona desértica del norte de Chile.
·Nitrato de potasio:
Rae;
1. m. Quím. Sólido cristalino e incoloro, soluble en agua, alcohol y glicerina, de
gran poder oxidante y con diversos usos industriales.
·Nitrato de sodio:
Rae;
1. m. Quím. Sólido cristalino higroscópico, componente principal del nitrato de Chile,
que es un oxidante muy enérgico y tiene uso en la industria del vidrio, en pirotecnia
y como fertilizante.
-Los nitratos inorgánicos: En los nitratos está presente el anión NO3-. El
nitrógeno en estado de oxidación +V se encuentra en el centro de un triángulo formado
por los tres oxígenos. La estructura es estabilizada por efectos mesoméricos.
Los nitratos inorgánicos se forman en la naturaleza por la descomposición de los
compuestos nitrogenados como las proteinas, la urea, etc. En esta descomposición se
forma amoníaco o amonio respectivamente. En presencia de oxígeno éste es oxidado por
microorganismos de tipo nitrobacter a ácido nítrico que ataca cualquier base (generalmente
carbonatos) que hay en el medio formado de nitrato correspondiente.
Otra fuente de formación es a través de los óxidos de nitrógeno que se generan
en las descargas eléctricas de las tormentas a partir de nitrógeno y del oxígeno del
aire. Con el agua de la lluvia de nuevo se forma ácido nítrico que ataca los carbonatos
y otros minerales básicos que encuentra en el medio para formar los nitratos correspondientes.
-Los nitratos orgánicos: Los nitratos orgánicos son ésteres del ácido nítrico con
alcoholes. El nitrato orgánico más conocido es, probablemente, la nitroglicerina, formada
a partir de una mezcla de glicerina, ácido nítrico y ácido sulfúrico concentrado.
Utilizando la misma mezcla de reactivos menos concentrado sobre la celulosa y
tratando el producto generado con un químico X se obtiene el celuloide.
El nitrato de amilo (O2NO(CH2)4CH3)se utiliza en medicina por sus efectos sobre
el sistema cardiovascular. La nitroglicerina demuestra efectos parecidos por razon de
que las formulaciones que se usan en medicina no son explosivos. En la administración
de nitroglicerina, un potente vasodilatador, se prefiere la via sublingual, la cual
evita considerablemente el paso por el hígado.
/// ·Nitrificación:
WikipediA (23/05/2016); La nitrificación es la oxidación biológica de amonio
con oxígeno en nitrito seguido por la oxidación de esos nitritos en nitratos. La
nitrificación es una etapa importante en el ciclo del nitrógeno en los suelos. Este
proceso fue descubierto por el microbiólogo ruso Sergei Wnogradsky y en realidad
consiste en dos procesos.
Nitritación. Partiendo de amonio se obtiene nitrito (NO2-). Lo realizan
bacterias de, entre otros, los géneros Nitrosomonas y Nitrosococcus.
Nitratación. Partiendo de nitrito se produce nitrato (NO3-). Lo realizan
bacterias del género Nitrobacter.
·Nitrito.
Rae;
1. m. Quím. Sal formada por la combinación del ácido nitroso con una base.
·Nitrógeno:
Rae; De francés ·nitrogène· de nitro- ·nitro-· y -gène ·-geno·. 1. m. Elemento
químico gaseoso, de número atómico 7, inerte, incoloro, inodoro e insípido, abundante
en la corteza terrestre, presente en todos los seres vivos, que constituye las cuatro
quintas partes del aire atmosférico en su forma molecular N2, y que se usa en la
fabricación de amoniaco, ácido nítrico, explosivos y fertilizantes y, en su forma
líquida, en la conservación, a muy baja temperatura, de material biológico como
embriones, sangre, tejidos, etc. (Símbolo N). 2. m. Gas de nitrógeno en su forma
molecular. (Símbolo N2).
/// <>Nitrógeno<>:
WikipediA - (29/01/2017-Domingo.16:38);
El nimatrógeno es un elemento químico de numero atómico 7, símbolo N y que en condiciones normales forma un gas diatómico (nitrógeno diatómico o molecular) que constituye del orden del 78% del aire atmosférico. En ocasiones es llamado ázoe -antiguamente se usó también Az como símbolo del nitrógeno.
/// ·Nitrógeno líquido:
WikipediA - (21/11/2016-lunes); El nitrógeno líquido es nitrógeno puro en
estado líquido a una temperatura igual o menor a su temperatura de ebullición, que
es de -195,8 ºC a una presión de una atmósfera. El nitrógeno líquido es incolor e
inodoro. Su densidad en el punto triiple es de 0,807 g/ml.
Se produce industrialmente en grandes cantidades por destilación fraccionada del
aire líquido. A la hora de manipular es recomendable leer la HDSP (hoja de
seguridad del producto) debido a que es un gas inerte (desplaza el oxígeno) y debido
a su baja temperatura puede producir quemaduras.
·Nivel:
Rae; Del occitano nivel. 1. Medida de una cantidad con referencia a una
escala determinada. Nivel de renta, de glucosa etc.
/// ·No metal:
WikipediA (05/06/2016);
Se denomina no metales, a los elementos químicos opuestos a los metales pues
sus caracteristicas son totalmente diferentes. Los no metales, excepto el hidrógeno (H),
están situados en la tabla periódica de los elementos en el bloque p. Los elementos
de este bloque son no-metales, excepto los metaloides; boro (B), Silicio (Si),
Germanio (Ge), Arsénico (As), Antimonio (Sb), Telurio (Te), Polonio (Po); y los metales,
Aluminio (Al), Galio (Ga), Indio (In), Estaño (Sn), Talio (Tl), Plomo (Pb), Bismuto (Bi),
Ununtrio (Uut), Flerovio (Fl), Unumpentio (Uup), Livermonio (Lv): Son no metales, los gases
nobles, Helio (He), Neón (Ne), Argón (Ar), Kriptón (Kr), Xenón (Xe), Radón (Rn),
Ununoctio (Uuo). Los halógenos, Flúor (F), Cloro (Cl), Bromo (Br), Yodo (I), Astato (At),
Ununseptio (Uus). Mas los otro no metales, Carbono (C), Nitrógeno (N), Oxígeno (O),
Fósforo (P), Azufre (S), Selenio (Se).
www.ejemplode.com. (05/06/2016);
Caracteristicas de los no metales; Los no metales son elementos químicos que se
definen por ser diametralmente opuestos a los metales, estos elementos pierden las
cualidades que caracterizan a los metales. Los no metales pueden ser desde gases hasta
cloruros. ACIDEZ- Se caracterizan por su acidez, pues la gran mayoría de los óxidos
de los no metales forman algunas soluciones ácidad. BRILLANTEZ- Por su naturaleza los
no metales tienen poca brillantez a diferencia de los metales. CALOR- La transmisión
de calor es más reducida en los no metales. CONDUCTIBILIDAD- Los no metales no son
buenos conductores, aunque esto no quiere decir que no puedan conducir. DUCTIBILIDAD-
Los no metales no tienen la capacidad de doblarse o estirarse, por lo que no se pueden
hacer láminas mediante deformaciones plásticas. GASES- Estos elementos en su gran mayoría
son gases. PROPIEDADES QUÍMICAS- Entre las propiedades químicas de los no metales
es que en su última capa tienen desde 4 hasta 7 electrones y al ionizarse pueden
adquirir carga negativa y con el oxígeno forman oxidaciones no metálicas o anhídridos.
SEMICONDUCCIÓN- Estos elementos por su reducida o nula conducción son utilizados como
aislantes o como semiconductores dentro de los aparatos y dispositivos.
monografias.com - laya-crispina - Metales y no metales. (05/06/2016);
Los no metales varían mucho en su apariencia no son lustrosos y por lo general son
malos conductores del calor y la electricidad. Sus puntos de fusión son más bajos que
los de los metales (aunque el diamante, una forma de carbono, se funde a 3570ºC. Varios
no metales existen en condiciones ordinarias como moléculas diatómicas. En esta lista
están incluidos conco gases (H2, N2, O2, F2 y C2), un líquido (Br2) y un sólido
volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el
diamante o blandos como el azufre. Al contrario de los metales, son muy frágiles y
no pueden estirarse en hilos ni en láminas. Se encuentran en los tres estads de la
materia a temperatura ambiente: son gases (como el oxígeno), líquidos (bromo) y
sólidos (como el carbono). No tienen brillo metálico y no reflejan la luz. Muchos
no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno,
nitrógeno, fósforo y azufre en cantidades importantes. Otros son oligoelementos:
flúor, silicio, arsénico, yodo, cloro.
·Nódulo.
Rae; Del latín ·nodûlus· "nudo pequeño".
1. m. Concreción de poco volumen.
·Nomenclatura:
Rae; Del latín ·nomenclatûra·. 1. f. Lista de nombres de personas o cosas.
2. f. Conjunto de voces técnicas propias de una disciplina. Nomenclatura química.
·Nomenclatura biológica:
rae; 1. f. Bot. y zool. Conjunto de principios y reglas que se aplican para la
denominación inequívoca, única y distinta de los taxones animales y vegetales.
/// <>Nomenclatura D - L<>:
www.ehu.eus - (10/04/2017 - Lunes. 16:54);
El caso más frecuente de ausencia de plano de simetría se debe a que
algún carbono tetraédrico está unido a cuatro radicales distintos. Este carbono
recibe el nombre de carbono asimétrico (Figura de la derecha). Para representar
en un plano los carbonos asimétricos se han ideado varias representaciones
convencionales en proyección. La más utilizada es la de Fischer (Figura de
la derecha). Según esta convención, se proyecta la molécula sobre el plano del
papel con las siguientes condiciones:
● 1º. - La cadena carbonada se sitúa en vertical, con las valencias
que la integran en dirección a la parte posterior del plano.
● 2º. - La cadena se orienta con la parte más oxidada hacia arriba
y la más reducida hacia abajo.
● 3º. - Las valencias que no integran la cadena carbonada resultan
horizontales y dirigidas hacia la parte anterior del plano.
Cuando se aplica esta convención, se denomina isómero Dal que presenta el
grupo funcional a la derecha del espectador e isómero L al que lo
tiene hacia la izquierda (Tabla inferior):
● en los azúcares se considera grupo funcional al grupo OH
del penúltimo carbono (por ser el carbono asimétrico más alejado del grupo
aldehído o cetona).
● en los aminoácidos se considera grupo funcional al
grupo amino (NH2) del segundo carbono (carbono α)
En la siguiente tabla se ilustra el caso del gliceraldehído y el de un aminoácido:
La nomenclatura D-L no indica si el compuesto es dextrógiro o levógiro.
En el caso de gliceraldehído, el isómero D es dextrógiro, y se indica con el signo
(+), pero no simpre tiene qué ser así.
La nomenclatura D-L es inequívoca para designar la configuración de isómeros
con un solo carbono asimétrico. Sin embargo, cuando en una molécula hay varios
centros de asimetría es más conveniente utilizarse el sistema propuesto por
Cahn, Ingold y Prelog.
Para ver los dibujos debes ir a esta dirección."http://www.ehu.eus/biomoleculas/moleculas/dl.htm".
/// <>Nomenclatura de adición<>:
ejercicios-fyq.com - (11/02/2017- Sábado. 18:53);
Esta forma de nombrar considera un átomo central
al que se unen los demás átomos (o grupos de átomos) como si fueran ligandos. Esta
nomenclatura es especialmente útil para nombrar los oxocompuestos. Los átomos
considerados como ligandos se deben nombrar por alfabético y usando los prefijos
numerales. No se usan los números de oxidación
Fórmula --- Nombre
Si(OH)4 --- Tetrahidróxido de silicio
OCl2 --- Dicloruro de oxígeno
OClF --- Fluoruroóxido de cloro
Fijate en que este tipo de nomenclatura es muy similar a la de composición pero
prescindiendo de las referencias a los estados de oxidación o números de carga.
Es importante señalar también que en los oxocompuestos (como es el caso de OClF)
usaremos "óxido" a la hora de nombrar y es una gran diferencia con respecto a
nomenclaturas obsoletas.
La conclusión que podemos obtener es que no existe un único mombre para cada
compuesto sino que depende del tipo de nomenclatura que adoptemos. Su un nombre
describe un compuesto de manera inequivoca y suficiente diremos que es correcto.
Es importante evitar mezclar la forma de nombrar en cada una de las
nomenclaturas explicadas para no llegar a nombres incorrectos. A lo largo del
tema iremos viendo qué nomenclatura es más cómoda para cada tipo de compuesto.
/// <>Nomenclatura de composición<>:
ejercicios-fyq.com - (11/02/2017- Sábado. 18:20);
También es llamada nomenclatura estequiomética
. Esta forma de nombrar está basada en qué tipo de
átomos componen la molécula o compuesto. Esta nomenclatura sólo da información
sobre qué tipo de átomos están en la sustancia y en qué proporción están.
La proporción en la que se encuentran los distintos átomos se pueden expresar
usando los prefijos numerales, los números de oxidación e incluso el número de
carga (para compuestos iónicos).
Veamos algunos ejemplos:
Fórmula --- Nombre (Prefijos) --- Nombre (Nº Oxidación) --- Nombre (Nº Carga)
Hg2Cl2 --- Dicloruro de dimercurio --- Cloruro de mercurio (I) --- Cloruro de mercurio (1+)
PCl5 --- Pentacloruro de fósforo --- Cloruro de fósforo (V) --- -
Fe2O3 --- Trióxido de dihierro --- Óxido de hierro (III) --- Óxido de hierro (3+)
Observa que no procede el nombre con el número de carga en el compuesto que no es iónico.
La conclusión que podemos obtener es que no existe un único mombre para cada
compuesto sino que depende del tipo de nomenclatura que adoptemos. Su un nombre
describe un compuesto de manera inequivoca y suficiente diremos que es correcto.
Es importante evitar mezclar la forma de nombrar en cada una de las
nomenclaturas explicadas para no llegar a nombres incorrectos. A lo largo del
tema iremos viendo qué nomenclatura es más cómoda para cada tipo de compuesto.
/// <>Nomenclatura de sustitución<>:
ejercicios-fyq.com - (11/02/2017- Sábado. 18:55);
El origen de esta nomenclatura son los hidruros
no metátlicos, que son nombrados como los hidrocarburos y usando los sufijos que
fueran necesarios. Vamos a poner en una tabla los nombres que la IUPAC da a estos
compuestos de partida.
Grupo 13 .....--- Grupo 14..... --- Grupo 15..... --- Grupo 16.......--- Grupo 17
BH3 Borano --- CH4 Metano --- NH3 Azano --- H2O Oxidano --- HF Fluorano
AlH3 Alumano --- SiH4 Silano --- PH3 Fosfano --- H2S Sulfano --- HCl Clorano
GaH3 Galano --- GeH4 Germano --- AsH3 Arsano --- H2Se Selano --- HBr Bromano
InH3 Indigano --- SnH4 Estannano --- SbH3 Estibano --- H2Te Telano --- HI Yodano
TlH3 Talano --- PbH4 Plumbano --- BiH3 Bismutano --- H2Po Polano --- HAt Astatano
La IUPAC sigue aceptando, como no podía ser de otro modo, los nombres de
amoniaco para el NH3 y agua para el H2O.
En el caso de hidruros de estos elementos pero con otros estados de oxidación,
habrá que nombrarlos usando la letra griega lambda con un superíndice que
indique el estado de oxidación y unido al nombre del compuesto de partida con un
guión. Observa los siguientes ejemplos:
Fórmula .....--- Nombre de sustitución
PH5...........--- λ5-fosfano
SnH2...........--- λ2-estannano
H6S...........--- λ6-sulfano
PbH2...........--- λ2-plumbano
Puede ocurrir que tengamos una molécula formada por dos o más átomos no
metálicos unidos entre sí. En ese caso debemos usar los prefijos numerales para
nombrar el compuesto. Veamos algunos ejemplos:
• H2O2: Se puede escribir como HO-OH y su nombre
sera dioxidano.
• N2H4: Su fórmula semidesarrollada sería
H2N-NH2 y su nombre de sustitución será diazano.
• H2S4: Podríamos escribirlo com HS-S-S-SH y su
nombre es tetrasulfano.
Otra posibilidad sería que entre los átomos no metálicos se establecieran
dobles o triples enlaces. En ese caso haremos uso de los sufijos que se usa en
la nomenclatura orgánica: -eno para los dobles enlaces e -ino para
los triples.
• HN=NH: Su nombre es diazeno.
• HSi≡SiH: Su nombre es disilino.
Por último vemos cómo se nombrarían compuestos en los que ha sido sustituido
alguno de los hidrógenos por otro tipo de átomos. Más adelante profundizaremos un
poco más en este apartado:
• NHCl2: Dicloroazano.
• PH2Br: Bromofosfano.
• OCl2: Diclorooxidano.
La conclusión que podemos obtener es que no existe un único mombre para cada
compuesto sino que depende del tipo de nomenclatura que adoptemos. Su un nombre
describe un compuesto de manera inequivoca y suficiente diremos que es correcto.
Es importante evitar mezclar la forma de nombrar en cada una de las
nomenclaturas explicadas para no llegar a nombres incorrectos. A lo largo del
tema iremos viendo qué nomenclatura es más cómoda para cada tipo de compuesto.
/// <>Nomenclatura química<>:
WikipediA - (11/02/2017- Sábado. 17:32);
La nomenclatura química
(del latín nomenclatura es un conjunto de
reglas o fórmulas que se utilizan para nombrar todos los elementos y los
compuestos químicos. Actualmente la IUPAC (Unión internacional de Química Pura y
Aplicada), es la máxima autoridad en materia de nomenclatura química, la cual se
encarga de establecer las reglas correspondientes.
/// <>Nomenclatura química de los compuestos inorgánicos<>:
WikipediA - (11/02/2017- Sábado. 17:40);
La
Unión Internacional de Química Pura y Aplicada
(IUPAC) ha recomendado una serie de reglas aplicables a la nomenclatura
química de los compuestos inorgánicos; las mismas se conocen comúnmente como
"El libro Rojo". Idealmente, cualquier compuesto debería tener un nombre del cual
se pueda extraer una fórmula química sin ambigüedad.
También existe una nomenclatura IUPAC para la Química orgánica. Los compuestos
orgánicos son los que contienen carbono, comúnmente enlazados con hidrógeno,
oxígeno, nitrógeno, azufre, boro, fósforo y algunos halógenos. El resto de los
compuestos se clasifican como compuestos inorgánicos, los más comunes son los
minerales. Estos se nombran según las reglas establecidas por la IUPAC.
Los compuestos inorgánicos se clasifican según la función química que contengan
y por el número de elementos químicos que los forman, con reglas de nomenclatura
particulares para cada grupo. Una función química es la tendencia de una
sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los
compuestos ácidos tienen propiedades químicas características de la función ácido,
debido a que todos ellos tienen el ion hidrógeno y que dona H+ : y las
bases tienen propiedades características de este grupo debido al ion OH-
presente en estas moléculas y que recibe protones. Las principales funciones
químicas son: óxidos, bases, ácidos y sales.
/// <>Nomenclatura química de los compuestos orgánicos<>:
WikipediA - (11/02/2017- Sábado. 17:56);
La nomenclatura química de los compuestos orgánicos
(del griego ???µat????t??; ???µa, nombre, y ???t??,
llamar. El término latino nomenclatura se refiere a una lista de nombres, al igual
que al nomenclador: esta palabra puede indicar un proveedor o el locutor de los
nombres) en química orgánica es una metodología establecida para denominar y
agrupar los compuestos orgánicos.
Nombrar "cosas" es una parte de nuestra comunicación en general por uso de
palabras y el lenguaje: es un aspecto de la taxonomía cotidiana para distinguir
los objetos de nuesta experiencia, junto con sus similitudes y diferencias, para
identificar, nombrar y clasificar. El uso de nombres, así como los diferentes
tipos de sustantivos incorporados en diferentes idiomas, conecta a la nomenclatura
con la lingüistica teórica, mientras que la forma de la estructura mental que se
utiliza para comprender el mundo en relación con el significado de las palabras
se estudia a través de la lógica conceptual y la filosofía del lenguaje.
Acutalmente, la Unión Internacional de Química Pura y Aplicada (IUPAC) es la
máxima autoridad en materia de nomenclatura química, la cual se encarga de
establecer las reglas correspondientes.
Las cadenas de Simplified Molecular Input Line Entry Specification (SMILES) se
utilizan de forma común para describir compuestos orgánicos, y es una forma de
"denominarlos".
/// <>Nomenclatura R - S<>:
www.ehu.eus - (10/04/2017 - Lunes. 17:14);
Configuración absoluta (de un átomo de carbono asimétrico)
La nomenclatura D-L es inequívoca para designar la configuración de isómeros
con un solo carbono asimétrico. Sin embargo, cuando en una molécula hay varios
centros de asimetría es más conveniente utilizar el sistema propuesto por
Cahn, Ingold y Prelog (foto de la izquierda), que permite establecer la
configuración absoluta de cada átomo. Con esta nomenclatura se puede asignar
un nombre sistemático y discriminativo a moléculas isoméricas complejas. Así, se
podrán distinguir y nombrar diferentes isómeros con varios carbonos asimétricos.
Según esta convención, las dos configuraciones posibles de cada carbono asimétrico
se designarían con las letras R y S (nomenclatrua R-S). En algunos casos,
R coincidirá con D, pero en otros no.
Para determinar la configuración de un carbono hay que seguir ciertas reglas.
Al igual que en el caso de la isomería geométrica (nomenclatura E-Z), se
jerarquizan los cuatros sustituyentes del carbono asimétrico usando el mismo
criterio (número atómico decreciente):
● 1º. - Se ordenan los cuatro grupos sustituyentes del carbono
asimétrico por orden decreciente de número atómico de los átomos enlazados
directamente con dicho carbono.
● 2º. - Si dos o más de estos átomos son iguales se recurre a
considerar los átomos unidos a ellos con el mismo criterio de preferencia.
● 3º. - Si la ambigüedad persiste, se atiende al tipo de enlace
que une los átomos en cuestión y se da preferencia al enlace triple sobre el
doble y al doble sobre el sencillo.
Una vez establecido el orden de prioridad es preciso orientar la molécula
en el espacio. El tetraedro correspondiente al carbono asimétrico se orienta de
modo que el sustituyente de menor categoría (el número cuatro) ocupe el
vértice más alejado del observador. De esta forma, los otros tres formarán
una cara triangular frente al espectador. Al recorrer esta cara en el orden
1º'→2º'→3º, el recorrido podrá ser:
● hacia la derecha (en sentido horario). En este caso se
tratará del isómero R (rectum = derecha)
● hacia la izquierda (en sentido antihorario). En este caso se
tratará del isómero S (sinister = izquierda)
A continuación tienes un ejercicio interactivo para determinar la
configuración absoluta de un átomo de carbono asimétrico.
Para ver los dibujos debes ir a esta dirección."http://www.ehu.eus/biomoleculas/moleculas/rs.htm".
/// <>Nomenclatura sistemática o IUPAC, con números romanos / Numeral de Stock<>:
WikipediA. Nomenclatura química de los compuestos inorgánicos - (11/02/2017- Sábado. 23:49);
También llamada antiguamente nomenclatura de Stock. Este
sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del
nombre con números romanos el estado de oxidación del elemento con "nombre específico".
Si solamente tiene un estado de oxidación, éste no se escribe.
La valencia (o más bien el estado de oxidación) es la que indica el número de
electrones que un átomo pone en juego en un enlace químico, un número positivo
cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar
electrones. De forma general, bajo este sistema de nomenclatura, los compuestos
se nombran de esta manera: nombre genérico + "de" + nombre del elemento
específico + el estado de oxidación.
Normalmente, a menos que se haya simplificado la fórmula, la valencia puede
verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los
números de valencia normalmente se colocan como superíndices del átomo (elemento)
en una fórmula molecular.
Ejemplo: Fe2S3, Fe2+3
S3-2, sulfuro de hierro (III).
Ejemplo: SO3, S2+6O6-2,
óxido de azufre (VI).
/// <>Nomenclatura sistemática o IUPAC, con prefijos / Atomicidad<>:
WikipediA. Nomenclatura química de los compuestos inorgánicos - (12/02/2017- Domingo. 00:06);
También llamada racional o estequiométrica.
Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican
la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad
indica el número de átomos de un mismo elemento en una molécula, como por ejemplo
el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos
átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera
más práctica, la atomicidad en una fórmula química también se refiere a la
proporción de cada elemento en una cantidad determinada de sustancia. En este
estudio sobre nomenclatura química es más conveniente considerar a la atomicidad
como el número de átomos de un elemento en una sola molécula.
La forma de nombrar los compuestos en este sistema es: prefijo-nombre
genérico + prefijo-nombre específico.
(Véase en la sección otras reglas nombre genérico y especifico).
Los prefijos son palabras que se anteponen al prefijo nombre del compuesto y
representan el número de átomos que hay en la molécula del elemento. Existen
diferentes prefijos los cuales provienen del griego y a continuación se presenta
el número de átomos al que hace referencia el prefijo.
(Generalmente solo se utiliza hasta el perfijo hepta-).
Prefijos griegos --- Número de átomos
mono-..............................1
di- ...............................2
tri- ..............................3
tetra- ............................4
penta- ............................5
hexa- .............................6
hepta- ............................7
octa- .............................8
non-,nona-, eneá- .................9
deca- .............................10
El prefijo mono- normalmente se elude salvo que haya posibilidad de
confusión.
Por ejemplo, CrBr3: tribromuro de cromo; CO: monóxido de carbono.
En casos en los que en vez de átomos se trate de grupos de átomos como
compuestos tales como sales dobles y triples, oxisales y similares, se pueden
emplear los prefijos bis-, tris-, tetraquis, pentaquis, hexaquis, etc
Por ejemplo la fluorapatita Ca5F (PO4)3:
fluoruro tris (fosfato) de calcio, ya que si se usara el término trifosfato
se estaria hablando de anión trifosfato [P3O10]5-,
en cuyo caso seria:
Ca5F (P3O10)3
/// <>Nomenclatura tradicional, clásica o antigua / Estequiométrica<>:
WikipediA. Nomenclatura química de los compuestos inorgánicos - (11/02/2017- Sábado. 23:11);
En este sistema de nomenclatura se indica la
valencia del elemento de nombre específico con una serie de prefijos y sufijos.
De manera general las reglas son:
● Cuando el elemento solo tiene una valencia, simplemente se coloca el
nombre del elemento precedido de la sílaba "de" o bien se termina el
nombre del elemento con el sufico -ico.
K2O, óxido de potasio u óxido potásico.
● Cuando tiene dos valencias diferentes se usan los sufijos -oso e
-ico.
...O-2, hierro con la valencia 2, (estado de oxidación +2),
óxido ferroso.
...-ico cuando el elemento usa la valencia mayor: Fe2
O3, Fe2+3O3-2, hierro
con valencia 3, (estado de oxidación +3), óxido férrico.
● Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
hipo- ...-oso (para la menor valencia): P2O,
P2+1O-2, fósforo con la valencia 1, (estado
de oxidación +1), óxido hipofosforoso.
...-oso (para la valencia intermedia): P2O3,
P2+3O3-2, fósforo con valencia
3, (estado de oxidación +3), óxido fosforoso.
...-ico (para la mayor valencia): P2O5,
P2+5O5-2, fósforo con valencia
5, (estado de oxidación +5), óxido fosfórico.
● Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos.
hipo-...-oso (para la valencia más pequeña).
...-oso (para la valencia pequeña).
...-ico (para la valencia grande).
per-...-ico (para la valencia mäs grande).
Hoy esta nomenclatura está en desuso. Sin embargo aún se usa mucho en el
comercio y la industria.
·Norma:
rae; Del latín ·norma· 'escuadra'. 1. f. Regla que se debe seguir o a que
se deben ajustar las conductas, tareas, actividades, etc. 2. f. Escuadra que usan
quienes arreglan y ajustan los maderos, piedras. etc. 3. f. Der. Precepto jurídico.
4. f. Ling. Conjunto de criterios lingüísticos que regulan el uso considerado correcto.
/// <>·Nosemosis<>:
WikipediA - (06/01/2017-Viernes-18:31); La nosemosis o nosematosis es una enfermedad producida por el parásito Microsporidio Nosema apis que afecta el aparato digestivo de las abejas obreras, los zánganos y de la abeja reina. El esporo N. apis es ingerido con el alimento y destruye las células epiteliales encargadas de la digestión y asimilación, de tal manera que no se aprovecha convenientemente el alimento ingerido. Produce una inflamación del intestino de la abeja, generando diarrea. Las esporas viven en las heces o evacuaciones durante más de dos años; en el suelo de 44 a 71 días, y en la miel durante dos a cuatro meses.
·Nuclear:
Rae; 1. adj. Perteneciente o relativo al núcleo. 2. adj. Fís. Perteneciente
o relativo al núcleo de los átomos. 3. adj. Perteneciente o relativo a la energía
producida por reacciones atómicas de fusión o fisión.
·Nucleico:
rae; Ácido nucleico. Bioquím. Nombre genérico de los ácidos ribonucleico y desoxirribonucleico.
·Núcleo:
rae; Del latín ·nucleus· "parte comestible de la nuez", hueso de fruta", "núcleo",
diminutivo de ·nux·, ·nucis· "nuez".1. m. Parte o punto central de algo
material o inmaterial. 8. Biol.
Orgánulo celular limitado por una membrana, que contiene el ADN de
los cromosomas y participa en los procesos de división celular. 2. Fís. Parte
central del átomo, que contiene la mayor porción de su masa, constituida por
protones y neutrones, y que posee una carga eléctrica positiva que se corresponde
con su número atómico.
/// <>Núcleo atómico<>:
energia-nuclear.net - (30/01/2017- Lunes.14:19);
El núcleo atómico . és la pequeña parte central del átomo, con carga eléctrica positiva y en la que se concentra la mayor parte de la masa del átomo.
Las principales partículas subatómicas de los núcleos de los átomos són los protones y los neutrones o los nucleones (excepto el del hidrógeno ordinario o protio, que contiene únicamente un protón). Un mismo elemento químico está caracterizado por el número de protones del núcleo que determina la carga positiva total. Éste número másico es el total de protones y neutrones.
·Nucleoide:
Núcleo celular delimitado dentro de una doble capa: La envoltura nuclear la cual
contiene su material hereditario, fundamentalmente su información genética. "Las
células eucariontes son las que tienen núcleo definido".
·Nucleolo; también Nucléolo:
Rae; Del latín nucleolus ·huesecillo de fruta·. 1. Biol. Orgánulo celular
situado en el interior del núcleo y encargado de la síntesis del ARN de los ribosomas.
/// ·Nucléolo:
WikipediA - (20/11/2016); En biología celular el nucléolo es una región del
núcleo que se considera una estructura supra-macromolecular, que no posee membrana
que lo limite. La función principal del nucléolo es la transcripción del ARN ribosomal
por la polimerasa I, y el posterior procesamiento y ensamblaje de los precomponentes
que formarán los ribosomas.
·Número:
Rae; Del latín ·numêrus·. 1. m. Expresión de una cantidad con ralación a
su unidad. 2. m. Signo o conjunto de signos con que se representa el número.
5. m. En una publicación periódica, cada una de las hojas o cuadernos correspondientes
a distinta fecha de edición, en la serie cronológica respectiva.
/// <>Número<>:
WikipediA - (05/03/2017 - Domingo. 20:49);
Un número,
en ciencia, es una abstracción que representa una cantidad o una magnitud. En
matemáticas un número puede representar una cantidad métrica o más generalmente
un elemento de un sistema numérico o un número ordinal que representará una posición
dentro de un orden de una serie determinada. Los números complejos son usados como
una herramienta útil para resolver problemas algebraicos y que algebraicamente son
un mero añadido a los números reales que a su vez ampliaron el concepto de número
ordinal. Sobre todo, un número real resuelve el problema de comparación de dos
medidas: tanto si son conmensurables o inconmensurables. Ejemplo: el lado de un
cuadrado es conmensurable con su perímetro, pero el lado del cuadrado con la
diagonal del mismo son inconmensurables.
También, en sentido amplio, indica el carácter gráfico que sirve para
representarlo; dicho signo gráfico de un número recibe propiamente la denominación
de numeral o cifra. El que se escribe con un solo guarismo se llama dígito.
El concepto de número incluye abstracciones tales como números fraccionarios,
negativos, irracionales, trascendentales, complejos y también números de tipo más
abstracto como los números hipercomplejos que generalizan el concepto de número
complejo o los números hiperreales, los superreales y los surreales que incluyen
a los números reales como subbonunto.
<>Número abstracto<>:
rae;
1. Mat. Número que no se refiere a unidad de especie determinada.
<>Número algebraico<>:
rae;
1. Mat. Número real o complejo que es raíz de un polinomio con
coeficientes enteros.
<>Número arábigo<>:
rae;
1. Mat. Cifra o guarismo perteneciente a la numeración arábiga.
<>Número atómico<>:
Rae;
1. m. Fís. y Quím. Número de protones presentes en el núcleo de los
átomos de un elemento, que determina la situación de este en el sistema periódico
y, por tanto, sus propiedades químicas.
/// Número atómico:
WikipediA (09/04/2016); Átomo es la porción más pequeña de cualquier elemento químico,
que no puede dividirse y que dispone de existencia independiente. Los átomos están
compuestos por electrones que orbitan en torno a un núcleo con neutrones y protones.
Los átomos de diferentes elementos presentan distintas cantidades de protones. El
número atómico (que se identifica con la letra Z, por el término alemán zahl) indica
la cantidad de protones que se encuentra presente en el núcleo de un átomo. Este número,
por lo tanto, se encarga de definir la configuración electrónica del átomo y permite
el ordenamiento de los diversos elementos químicos en la tabla periódica, que comienza
con el hidrógeno (Z=1) y sigue con el helio, el litio, el berilio, el boro, el carbono y
el nitrógeno.
Asimismo tenemos que añadir que ese número de protones que existe en el
núcleo de un átomo en concreto es igual al número de lectrones que lo rodea en lo
que se da en llamar corteza.
La lista de elementos químicos establecida en base al
número atómico de los mismos podemos determinar que está encabezada por estos diez
elementos: con el 1 el hidrógeno, con el número 2 el helio, el 3 es para el litio,
el 4 es el berilio, el 5 lo ocupa el boro, el 6 es el carbono, el 7 el nitrógeno,
el 8 el oxígeno, el 9 el flúor y el 10 el neón.
Es importante tener en cuenta que
un átomo no alterado es eléctricamente neutro: esto quiere decir que su número atómico
siempre será igual que su número de electrones.
Aunque la tabla periódica de los
elementos suele ser atribuida a Dimitri Mendelelev (responsable de ordenar los
elementos de acuerdo a las variaciones de las propiedades químicas), quien concretó
la organización según las propiedades físicas de los átomos fue Julius Lothar Meyer.
No obstante, tampoco se puede obviar el importante papel ejercido por el físico y
químico inglés Henry Moseley que estableció su propia ley de los números atómicos,
llamada Ley de Moseley. En 1913 fue cuando se dio a conocer la misma que establecía
que existía una clara relación de tipo sistemático entre la longitud de onda de
los rayos X que eran emitidos por los átomos y el número atómico de los mismos.
De esta forma, con dicho descubrimiento, este químico británico venía a oponerse
o a contrarestar las propuestas que cuatro décadas antes llevara a cabo el mencionado
Mendelévev.
Ya hemos dicho que el número de protones (expresado mediante el número
atómico) es igual al número de lectrones. El número másico (A), por su parte, índica
el número de particulas que un átomo dispone en su núcleo. Por lo tanto
/// <>Número atómico<>:
WikipediA - (12/02/2017- Domingo. 18:18);
En física y quimica, el número atómico
de un elemento químico es el número total de
protones que tiene cada átomo de ese elemento. Se suele representar con la letra
Z.
Los átomos de diferentes elementos tienen distintos números de electrones y
protones. Un átomo en su estado natural es neutro y tiene un número igual de
electrones y protones. Un átomo de sodio (Na) tiene un número atómico 11; posee
11 electrones y 11 protones. Un átomo de magnesio (Mg), tiene número atómico 12,
posee 12 electrones y 12 protones; y un átomo de uranio (U), que tiene número
atómico 92, posee 92 electrones y 92 protones.
Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente.
Por ejemplo, todos los átomos del elemento hidrógeno tienen 1 protón y su Z=1;
esto sería 1H. Los de helio tienen 2 protones y Z=2; asimismo,
2He. Los de litio, 3 protones y z=3,...
Si el átomo es neutro, el número de electrones coincide con el de protones y
da Z.
En 1913 Henry Moseley demostró la regularidad existente entre los valores de
las longitudes de onda de los rayos X emitidos por diferentes metales tras ser
bombardeados con electrones, y los números atómicos de estos elementos metálicos.
Este hecho permitió clasificar los elementos en la tabla pediódica en orden creciente
de número atómico. En la tabla periódica los elementos se ordenan de acuerdo con
sus números atómicos en orden creciente.
ORIGEN DE LA DENOMINACIÓN "Z". El simbolo convecional "Z" posiblemente proviene
de la palabra alemana Atomzahl (número atómico). Antes de 1915, la palabra
Zahl (simplemente número) era usada para el número asociado a cada elemento en la
tabla periódica.
<>Número aúreo<>:
Rae;
1. m. Número que se escribía con caracteres de oro en los sitios
públicos de Atenas, y correspondía al año en que, cada 19, se volvían a repetir
las fases lunares en las mismas fechas. 2. m. Astron. Ciclo lunar. 3. m. Arq.
Sección áurea.
<>Número cardinal<>:
Rae;
1. m. Mat. Cada uno de los números enteros en abstracto; por
ejemplo, cero, diez, mil.
<>Número complejo<>:
Rae;
1. m. Mat. Número imaginario. = 1. m. Mat. número con la forma
a + bi donde a y b son números reales e i es
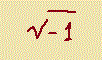
<>Número concreto<>:
Rae;
1. m. Mat. Número que expresa la cantidad de una especie determinada.
/// <>Número de Avogadro<>:
wikipediA - (06/03/2017 - Lunes. 17:10);
La constante de Avogadro
(símbolos: L, NA) es el número de partículas
elementales (usualmente átomos o moléculas) en un mol de una sustancia cualquiera,
donde el mol es una de las siete unidades básicas del Sistema internacional de
Unidades (SI). Su dimensión es el recíproco del mol y su valor es igual a
6,022 140 857(74) x 1023mol-1.
Definiciones anteriores de cantidad química involucraron el número de Avogadro,
un término histórico íntimamente relacionado a la constante de Avogadro pero
definida de otra forma: inicialmente definido por Jean Baptiste Perrin como el
número de átomos en un mol de hidrógeno. Luego fue redefinido como el número de
átomos en 12 gramos del isótopo carbono-12 y posteriormente generalizado para
relacionar cantidades de sustancias a sus pesos moleculares. Por ejemplo, de
formar aproximada, 1 gramo de hidrógeno, que tiene un número másico de 1, contiene
6,022 x 1023 átomos de hidrógeno, es decir, más de seiscientos mil
trillones de átomos. De igual manera, 12 gramos de carbono-12 (número másico de
12) contienen el mismo número de átomos, 6,022 x 1023. El número de
Avogadro es una magnitud adimensional y tiene el valor numérico de la constante
de Avogadro, que posee unidades de medida.
La constante de Avogadro es fundamental para entender la composición de las
moléculas y sus interacciones y combinaciones. Por ejemplo, ya que un átomo de
oxígeno se combinará con dos átomos de hidrógeno para crear una molécula de agua
(H2O), de igual forma un mol de oxígeno (6,022 x 1023
átomos de O) se combinará con dos moles de hidrógeno (2 x 6,022 x 1023
átomos de H) para crear un mol de H2O.
Revisiones en el conjunto de las unidades básicas de SI hicieron necesario
redefinir los conceptos de cantidad química, por lo que el número de Avogadro y
su definición fueron reemplazados por la constante de Avogadro y su definición.
Se ha propuesto que cambios en las unidades SI fijarán de manera precisa el valor
de la constante a exactamente 6,022 14X x 1023 al expresarla en la
unidad mol-1 (véase Redefinición de las unidades del SI; la X al final
de un número significa que uno o más dígitos finales poseen cierta incertidumbre).
| Valor de NA | Unidad |
|---|---|
| 6,022 140 857(74) x 1023 | mol-1 |
| 2,731 597 34(12) x 1026 | (lb-mol)-1 |
| 1,707 248 434(77) x 1025 | (oz-mol)-1 |
<>Número de guarismo<>:
Rae;
1. m. Mat. Número arábigo.
<>Número de mach<>:
Rae;
1. m. Ingen. Razón de equivalencia entre la velocidad de un objeto
en un medio y la velocidad del sonido en ese mismo medio.
<>Número de octano<>:
Rae;
1. m. Quím. Octanaje.
<>Número de oro<>:
Rae;
1. m. Arq. Sección áurea.
<>Número decimal<>:
Rae;
1. m. Mat. Número que consta de una parte entera y una decimal,
separadas por un punto o por una coma.
<>Número dígito<>:
Rae;
1. m. Mat. Número que puede expresarse con un solo guarismo, y que en
la numeración decimal es alguno de los comprendidos entre el cero y el nueve,
ambos inclusive.
<>Número dual<>:
Rae;
1. m. Gram. Número que expresa la referencia a dos unidades.
<>Número e<>:
Rae;
1. m. Mat. Número trascendente 2,7182..., que es la base de los
logaritmos neperianos. (Símbolo e).
<>Número entero<>:
Rae;
1. m. Mat. Número que consta exclusivamente de una o más unidades, a
diferencia de los quebrados y de los mixtos.
<>Número fraccionario<>:
Rae;
1. m. Mat. Número quebrado = Número que expresa una o varias
partes alícuotas de la unidad.
<>Número i<>:
Rae;
1. m. Mat. Número 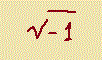
<>Número imaginario<>:
Rae;
1. m. Mat. Número con la forma
a + bi donde a y b son números reales e i es
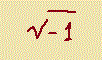
<>Número impar<>:
Rae;
1. m. Mat. Número entero que no es exactamente divisible por dos.
<>Número irracional<>:
Rae;
1. m. Mat. Número que, siendo real, no es racional; por ejemplo, π
(pi).
<>Número llano<>:
Rae;
1. m. Número romano.
<>Número másico<>:
Rae;
1. m. Fís y Quím. Suma de los número de protones y neutrones del núcleo
de un átomo, la cual es diferente en los diversos isótopos de un mismo elemento.
/// <>Número másico<>:
WikipediA - (12/02/2017- Domingo. 18:19);
En quimica, el número másico o
número de masa es la suma del número de protones
y el número de neutrones del núcleo de un átomo. Se simboliza con la letra A
(el uso de esta letra proviene del aleman Atomgewicht que quiere decir
peso atómico, aunque sean conceptos distintos que no deben confundirse).
Suele ser mayor que el número atómico, dado que los neutrones del núcleo
proporcionan a éste la cohesión necesaria para superar la repulsión entre los
protones.
El número másico es además el indicativo de los distintos isótopos de un
elemento químico. Dado que el número de protones es idéntico para todos los
átomos del elemento, sólo el número másico, que lleva implícito el número de
neutrones en el núcleo, indica de qué isótopo del elemento se trata. El número
másico se indica con un superíndice situado a la izquierda de su símbololo,
sobre el número atómico. Por ejemplo, el 1H es el isótopo de
hidrógeno conocido como protio. El 2H es el deuterio y el
3H es el tritio. Dado que todos ellos son hidrógeno, el
número atómico tiene que ser 1.
Para todo átomo o ion:
Número másico (A) = número atómico (Z) + número de neutrones (N)
A = Z + N
Para calcular la cantidad de neutrones que posee un átomo debe hacerse:
"A - Z", (Número másico menos número atómico) consultando antes en la tabla
periódica las cantidades correspondientes.
<>Número mixto<>:
Rae;
1. m. Mat. Número compuesto de entero y de quebrado.
<>Número natural<>:
Rae;
1. m. Mat. Cada uno de los elementos de la sucesión (0), 1,2,3....
/// <>Número natural<>:
WikipediA - (05/03/2017 - Domingo. 21:04);
En matemáticas, un número natural,
es cualquiera de los números que se usan para contar los elementos de ciertos
conjuntos, como también en operaciones elementales del cálculo.
Por definición convencional se dirá que cualquier miembro del siguiente
conjunto, N = {1,2,3,4,...} es un número natural, que en este caso empieza del
uno ya que el cero no es considerado un numero natural. De dos números vecinos
cuales quiera, el que se encuentra a la derecha se llama siguiente o
sucesivo, por lo tanto el conjunto de los números naturales es ordenado
e infinito.
El conjunto de todos los números naturales iguales o menores que cierto número
natural K, es decir, el conjunto {1,2,...,k-1,k}, se llama segmento
de una sucesión natural y se denota /1,k/ o bien /k/.
<>Número ordinal<>:
Rae;
1. m. Mat. Número que expresa ideas de orden o sucesión; por ejemplo,
primero, segundo, tercero.
<>Número par<>:
Rae;
1. m. Mat. Número entero que es exactamente divisible por dos.
<>Número perfecto<>:
Rae;
1. m. Mat. Número entero y positivo igual a la suma de sus divisores
positivos, excluido él mismo.
<>Número pi<>:
Rae;
1. m. Mat. Número trascendente 3,141592..., que expresa el cociente
entre la longitud de la circunferencia y la de su díametro. (Símbolo π).
<>Número plural<>:
Rae;
1. m. Gram. Número que se manifiesta a través de determinada concordancia
y que en nombres y pronombres normalmente expresa la referencia a varias entidades.
<>Número primo<>:
Rae;
1. m. Mat. Número entero que solo es exactamente divisible por sí mismo
y por la unidad; por ejemplo, 5, 7, etc.
<>Número quebrado<>:
Rae;
1. m. Mat. Número que expresa una o varias partes alícuotas de la unidad.
<>Número racional<>:
Rae;
1. m. Mat. Número que se expresa como cociente de dos enteros.
<>Número real<>:
Rae;
1. m. Mat. Número que se expresa por un entero o un decimal.
<>Número redondo<>:
Rae;
1. m. Número que con unidades completas de cierto orden expresa una
cantidad con aproximación y no exactamente.
<>Número romano<>:
Rae;
1. m. Número que se representa con letras del alfabeto latino; I (uno),
V (cinco), X (diez), L (cincuenta), C (cien), D (quinientos) y M (mil).
<>Número singular<>:
Rae;
1. m. Gram.Número que se manifiesta a través de determinada concordancia
y que en nombres y pronombres expresa la referencia a una unidad.
<>Número uno<>:
Rae;
1. m. Coloq. Persona o cosa que sobresale en algo, destacando sobre
todas las demás.
<>Números amigos<>:
Rae;
1. m. pl. Mat. Par de números en que cada uno de ellos es igual a la
suma de las partes alícuotas del otro; por ejemplo, el 284 y el 220.
<>Números congruentes<>:
Rae;
1. m. pl. Mat. Par de números enteros que, divididos por un tercer
número, llamado módulo, dan restos iguales.
<>Números primos entre sí<>:
Rae;
1. m. pl. Mat. Números enteros que no tienen divisores comunes; por
ejemplo, el 8 y el 9.
·Nutrir:
rae; 1.Aumentar la sustancia del cuerpo animal o vegetal por medio del alimento,
reparando las partes que se van perdiendo en virtud de las acciones catabólicas.
2. Aumentar o dar nuevas fuerzas en cualquier línea, especialmente en lo moral.
